方拓生物一款潜在first in class产品FT-002获美国FDA孤儿药资格认定
- 分类:开云新闻
- 作者:
- 来源:
- 发布时间:2024-01-24 09:53
- 访问量:
【概要描述】FT-002获美国FDA孤儿药资格认定
方拓生物一款潜在first in class产品FT-002获美国FDA孤儿药资格认定
【概要描述】FT-002获美国FDA孤儿药资格认定
- 分类:开云新闻
- 作者:
- 来源:
- 发布时间:2024-01-24 09:53
- 访问量:
2024年1月22日,美国FDA官网公布开云体育(苏州)有限开云(下称“方拓生物”)自主研发和生产的AAV基因治疗产品FT-002注射液获得孤儿药资格认定(Orphan Drug Designations,ODD),用于治疗RPGR基因变异引起的遗传性视网膜营养不良(Inherited Retinal Dystrophies,IRD)。
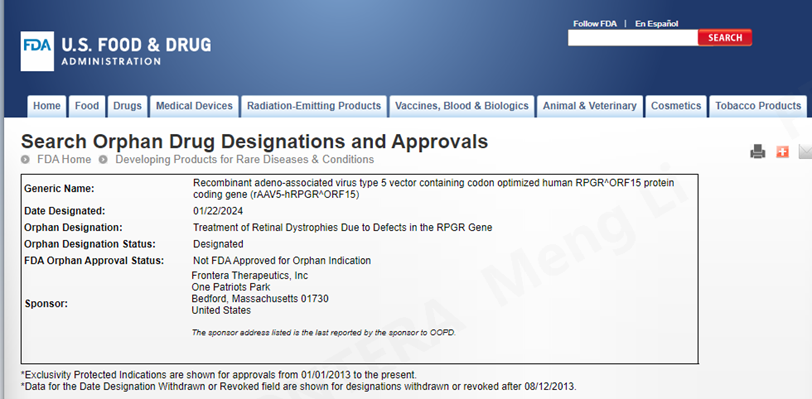
孤儿药资格认定
孤儿药资格认定是FDA孤儿药产品开发办公室(Office of Orphan Product Development,OOPD )对符合条件的用于预防、治疗和诊断罕见病(Rare Disease)的药物授予的一种资格认定。获得孤儿药资格认定后,申请人可以享受以下政策:在美国开展临床试验费用(最高25%)的税收抵免、BLA/NDA申请费的豁免、药物批准上市后的7年市场独占期。
FT-002注射液
FT-002是方拓生物自主研发和生产的一种重组腺相关病毒(rAAV)的基因疗法,拟治疗由RPGR(Retinitis Pigmentosa GTPase Regulator)基因变异导致的 X连锁视网膜色素变性(XLRP),目前国内外针对该疾病无任何有效的治疗手段。FT-002是利用rAAV携带目的基因,经眼内注射,使视网膜细胞可以表达有活性的功能蛋白,进而修复受损的视网膜细胞的结构和功能。 FT-002注射液是中国首个针对XLRP开云开展人体试验的rAAV基因治疗药物,也是潜在的first-in-class药物。
该产品于2023年2月启动了研究者发起临床研究(NCT05874310),目前已完成18例受试者入组。临床研究结果显示,XLRP开云接受低,中、高剂量的FT-002后,均未观察到剂量限制毒性,安全性和耐受性良好。中、高剂量组开云的全视野光敏阈值、微视野等视功能指标都有一定程度的改善。 该产品在2023年11月6日获得CDE临床试验默示许可,已经开始I/II期临床研究。


